在血管損傷出血時,,需要血小板激動劑(ADP和血栓素TXA2等)激活血小板促進凝血,。在病理條件下,血小板拮抗劑阿司匹林和雙嘧達莫可以抑制血栓形成,,是臨床上用于心血管疾病治療的常用藥物,。人類ABCC4蛋白屬于ABC轉運蛋白ABCC亞家族,不僅可以外排抗腫瘤,、抗病毒和抗菌藥物,,導致多藥耐藥性,而且還可以轉運很多生理底物,,參與重要的生理功能,。ABCC4在血小板中表達量較高,參與轉運血小板激動劑和拮抗劑,,因此是預防心血管疾病的潛在藥物靶標,。然而,ABCC4的三維結構及其轉運廣譜底物的分子機制未知,。
近日,,陳宇星教授和周叢照教授課題組利用單顆粒冷凍電鏡技術解析了人類ABCC4蛋白無配基結合(apo form)、三種底物結合(激動劑TXA2的類似物U46619,、拮抗劑阿司匹林和雙嘧達莫),,以及同時結合U46619和ATP的三維結構?;诮Y構分析和生化實驗,,闡明了ABCC4結合廣譜底物以及識別并轉運血小板激動劑和拮抗劑的分子機制,。相關研究成果以“Structural insights into human ABCC4-mediated transport of platelet agonist and antagonist”為題于06月20日在線發(fā)表在《Nature Cardiovascular Research》上,。并且,,該雜志同期發(fā)表題為“Insights into platelet pharmacology from a cryo-EM structure of the ABCC4 transporter”的評論文章高度評價了該項工作,,認為ABCC4轉運蛋白的結構解析是揭示血小板底物轉運進入致密體以及從血小板外排藥物關鍵分子機制的重要第一步,同時為理解血小板相互作用和特異性血小板拮抗劑的設計奠定了基礎,。
ABCC4在無配基和底物結合時呈現向內開口(inward-facing)構象,此時兩個核苷酸結合結構域(NBD)相互分離,,兩個跨膜結構域(TMD)形成一個朝向細胞質液開放的兼容性底物結合口袋(圖一),。該結合口袋由中心的疏水腔和外圍的極性氨基酸組成,,其中疏水腔負責穩(wěn)定底物的疏水核心,而極性氨基酸則與底物的極性基團形成氫鍵相互作用,。ATP結合使得兩個NBD發(fā)生二聚化,帶動兩個TMD相互靠近,,ABCC4由向內開口構象轉變?yōu)閷毎|液和細胞外均封閉的向外開口(outward-facing occluded)構象(圖一),。通過結構分析結合生化實驗,,我們證明血小板激活劑TXA2和拮抗劑阿司匹林均是ABCC4的底物,,同時發(fā)現雙嘧達莫是ABCC4的強競爭性抑制劑,進而闡明了其與阿司匹林臨床聯用的分子機制。該研究不僅揭示了ABCC4識別廣譜底物的分子機制,,而且為理性設計靶向ABCC4的血小板拮抗劑以及預防心血管疾病的藥物奠定了結構基礎,。
中國科學技術大學陳宇星教授,、周叢照教授和李瓊特任副研究員為該論文的共同通訊作者,博士生陳宇為該論文的第一作者,。冷凍電鏡數據收集工作在中國科學技術大學冷凍電鏡中心完成,。該研究工作得到科技部、中國科學院和中央高校基本科研業(yè)務費的資助,。
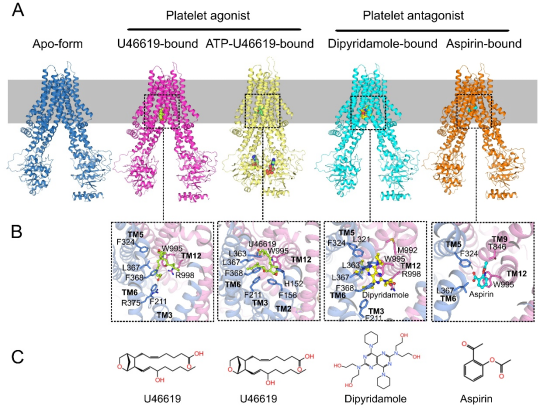
圖一 人類ABCC4蛋白的三維結構及底物結合口袋
原文鏈接:https://www.nature.com/articles/s44161-023-00289-9
評論文章鏈接:https://www.nature.com/articles/s44161-023-00293-z
(生命科學與醫(yī)學部,、科研部)

