10月2日,中國科學(xué)技術(shù)大學(xué)生命科學(xué)與醫(yī)學(xué)部,、免疫應(yīng)答與免疫治療重點實驗室周榮斌/江維/王夏瓊團隊在《自然-免疫學(xué)》在線發(fā)表題為“GPR34 is a metabolic immune checkpoint for ILC1-mediated antitumor immunity”的研究論文,報道了腫瘤來源的脂質(zhì)代謝物溶血磷脂酰絲氨酸(LysoPS)可通過其受體GPR34抑制ILC1s的抗腫瘤活性,,而拮抗GPR34受體可以誘導(dǎo)強效的ILC1s介導(dǎo)的抗腫瘤免疫從而抑制肝癌,、結(jié)直腸癌等實體腫瘤生長,。
以PD1抗體為代表的腫瘤免疫治療近年來取得了較大進展,改變了腫瘤的治療模式,,但目前響應(yīng)率不到30%,,對肝癌、結(jié)直腸癌等效果尤其不佳,,亟需發(fā)展新的腫瘤免疫治療策略和靶點,。NK細胞在腫瘤免疫中發(fā)揮重要作用,具有應(yīng)答快,、抑瘤譜廣,、通用性好、毒性小等特點,,正在成為全球競爭的新賽道,,但是由于腫瘤局部獨特的微環(huán)境,常規(guī)NK細胞(conventional NK, cNK)存在“進入腫瘤組織難”“進入后功能被抑制”等瓶頸問題,。除了cNK外,,在肝臟、腸道等組織存在大量的1型固有樣淋巴細胞(type 1 Innate Lymphoid cells,ILC1s),。ILC1s也被稱為組織駐留NK細胞,,近年來被發(fā)現(xiàn)同時具有促腫瘤和抗腫瘤的活性,但由于其與cNK細胞在表型上具有很大的相似性,,目前缺乏靶向ILC1s的干預(yù)手段,,其在腫瘤免疫中的功能尚不明確。
在該項研究中,,研究人員通過構(gòu)建tdTomato-GPR34報告鼠,,發(fā)現(xiàn)GPR34在ILC1s上高表達,而在cNK細胞上不表達,,提示GPR34可以作為一個新的區(qū)分ILC1s和cNK的標(biāo)志物,。進一步利用多種不同的皮下瘤和結(jié)腸癌肝轉(zhuǎn)移的原位瘤模型,研究人員發(fā)現(xiàn)GPR34全身基因缺陷或ILC1s條件缺陷均能增加腫瘤中ILC1s的比例,、數(shù)目和抗腫瘤活性,,并抑制腫瘤生長,表明GPR34通過抑制ILC1s的抗腫瘤活性來促進腫瘤生長,。
接下來,,研究人員探究了GPR34調(diào)控ILC1s介導(dǎo)的抗腫瘤免疫的機制。通過質(zhì)譜檢測,發(fā)現(xiàn)GPR34配體LysoPS在腫瘤間質(zhì)液積累,。體外實驗表明LysoPS以GPR34依賴的方式通過cAMP-PKA-CREB途徑抑制ILC1s的活化,。敲低腫瘤細胞上LysoPS合成酶ABHD16A的表達可以降低腫瘤間質(zhì)液中LysoPS的水平并抑制了腫瘤的生長。此外,,抑制腫瘤中LysoPS的產(chǎn)生可增加腫瘤中ILC1s的數(shù)量、比例以及抗腫瘤活性,。這些結(jié)果表明,,腫瘤來源的LysoPS通過GPR34抑制ILC1s介導(dǎo)的腫瘤免疫從而促進腫瘤生長。
進一步的研究發(fā)現(xiàn),,不管是在皮下腫瘤模型還是肝轉(zhuǎn)移模型中,,利用抑制劑阻斷GPR34均可抑制腫瘤生長,且GPR34抑制劑與抗TIGIT抗體聯(lián)合使用可提高腫瘤治療的效率,。
最后,,研究人員探討了LysoPS-GPR34-ILC1s通路在人類癌癥中的臨床相關(guān)性,發(fā)現(xiàn)GPR34mRNA在結(jié)腸腺癌,、頭頸癌或肝細胞癌患者腫瘤組織中的ILC1樣細胞上高表達,,而在cNK細胞上表達較低,且ABHD16A和GPR34的表達與癌癥患者ILC1s的抗腫瘤活性呈負相關(guān)性,。
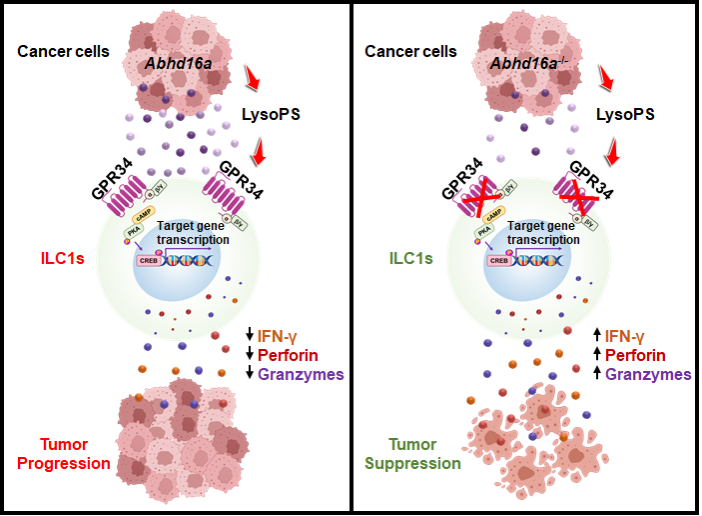
綜上所述,,該研究發(fā)現(xiàn)腫瘤來源的脂質(zhì)代謝物L(fēng)ysoPS可通過其受體GPR34抑制ILC1s的抗腫瘤活性,而拮抗GPR34可增強ILC1s的抗腫瘤活性并抑制腫瘤生長,。研究的創(chuàng)新性體現(xiàn)在:1)率先證明靶向ILC1s(組織駐留NK)可以誘導(dǎo)抗腫瘤免疫并抑制腫瘤生長,,提示靶向組織駐留的免疫細胞對實體腫瘤可能為一種潛在的有效策略;2)發(fā)現(xiàn)危險信號感應(yīng)受體GPR34為一個新的代謝免疫檢查點,。
中國科學(xué)技術(shù)大學(xué)博士后顏家賢,、博士研究生張馳、博士后胥月麗和博士研究生黃宗暉為該論文的第一作者,。中國科學(xué)技術(shù)大學(xué)生命科學(xué)與醫(yī)學(xué)部,、免疫應(yīng)答與免疫治療重點實驗室周榮斌、江維教授和王夏瓊副研究員為該論文的共同通訊作者,。該研究的合作者包括中國科學(xué)技術(shù)大學(xué)黃光明教授和中國科大附屬第一醫(yī)院錢小軍和朱亮副主任,,該研究得到了基金委、科技部,、中國科學(xué)院的項目支持,。
論文鏈接:https://www.nature.com/articles/s41590-024-01973-z
(生命科學(xué)與醫(yī)學(xué)部、科研部)

